Pharming commercialiseert en ontwikkelt een innovatief portfolio van eiwitvervangende therapieën en precisiegeneesmiddelen, waaronder kleine moleculen en biologische geneesmiddelen.
Onze portfolio
Hieronder een overzicht van de status van ons (kandidaat)-productportfolio.
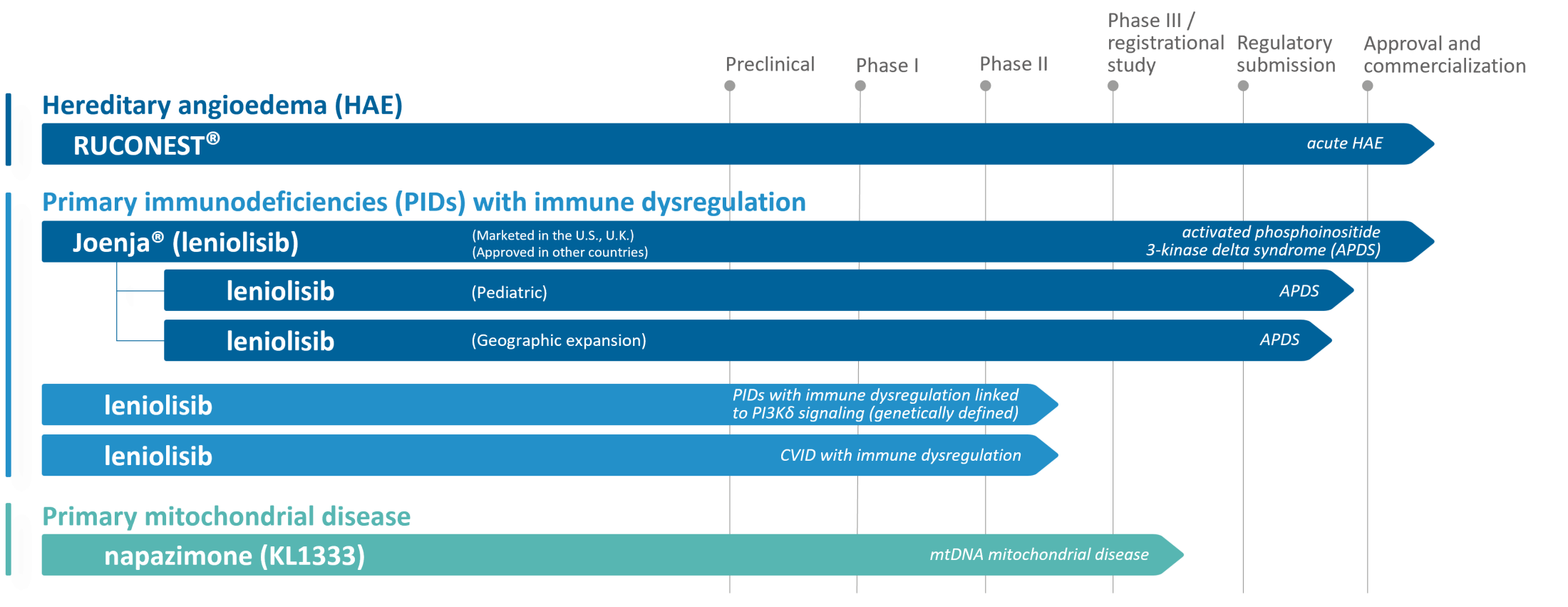
DEVELOPMENT PROGRAMS
GEACTIVEERD PI3Kδ-SYNDROOM (APDS)
Geactiveerd Phosphoinositide 3-kinase Delta (PI3Kδ) Syndroom, of APDS, is een zeldzame, genetische en progressieve primaire immunodeficiëntie. APDS werd in 2013 ontdekt en is een aandoening die het immuunsysteem en de functie van de witte bloedcellen, die virussen en bacteriën herkennen en aanvallen om infectie te voorkomen, aantast.
PRIMAIRE (AANGEBOREN) IMMUUN-AANDOENINGEN (PIDs)
MET IMMUUN-DISREGULATIE
Primaire (aangeboren) immuun-aandoeningen (PID's) met immuun-disregulatie gekoppeld aan veranderde PI3Kẟ signalering in lymfocyten , waaronder onder andere ALPS-FAS, CTLA4 haplo-insufficiëntie, NFKB1 haplo-insufficiëntie en PTEN-deficiëntie. De unieke genetische drijfveren in deze PIDs leiden tot waarneembare kenmerken van immuundisregulatie vaak net als bij APDS.

